TG 市場動態與應用案例
TissueGnostics全景組織細胞定量分析系統
Nature Metab | 揭示驅動腫瘤發生的表觀遺傳調控新機制
癌基因cMyc是一個重要的轉錄因子,調控約15%的人類基因表達,在腫瘤細胞的增殖、凋亡以及代謝重編程等方面發揮重要作用。然而,目前尚不清楚,cMyc是否通過轉錄以外的機制,來廣泛地調控基因的表達以及腫瘤的發生發展。
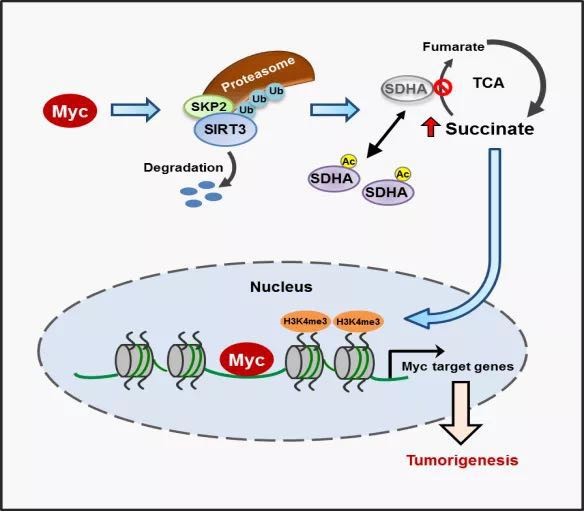
中國科學技術大學張華鳳課題組、高平課題組聯合軍事醫學科學院段小濤課題組研究發現,cMyc能夠促使琥珀酸脫氫復合酶(SDH complex)中的重要亞基SDHA乙酰化以及SDH復合酶失活,導致底物琥珀酸(succinate)的積累,進而上調組蛋白H3K4的三甲基化(H3K4Me3)水平以及基因的表達。機制方面,發現cMyc通過泛素連接酶SKP2促進線粒體中SIRT3的蛋白降解,從而導致SDHA的乙酰化水平上升。
體內外實驗證實,cMyc調控SDHA的乙酰化位點K335能夠顯著影響腫瘤進程。進一步分析臨床病人彌散性大B細胞瘤(DLBCL)樣本發現,高表達cMyc的DLBCLs中,SIRT3發揮著抑癌因子的功能,而K335位乙酰化的SDHA發揮著促進腫瘤的作用。
實驗揭示了cMyc驅動的腫瘤發生過程中SDHA乙酰化修飾發揮的重要病理學作用。SDHA被認為是抑癌蛋白,它的失活突變體與多種腫瘤,例如副神經結瘤、乳腺癌、腎癌等,有一定程度的聯系。
研究表明,至少在彌散性大B細胞淋巴瘤中,SDHA通過乙酰化失活而極大地促進了cMyc異常表達的腫瘤的進展。因此,靶向乙酰化SDHA將可能為此類腫瘤的臨床治療提供潛在的策略和手段。

該文章于2020年3月16日發表在Nature Metabolism雜志(IF=22.154)上。
實驗部分利用TissueFAXS Cytometry技術對免疫組化樣本進行成像和定量分析。
實驗方法
將55個DLBCL樣品分為兩組,一組具有高Myc表達(27個樣品的MOD≥50%),另一組具有相對較低的Myc表達(28個樣品的MOD <50%)。免疫組化樣本圖像及分析結果顯示SIRT3蛋白呈陰性,而Lys 335-乙酰化的SDHA和H3K4me3呈陽性,與Myc表達相關。
在對臨床DLBCL和正常淋巴結免疫組化樣本分析得出,在低Myc表達的DLBCL和高Myc表達的正常淋巴結樣本中,SIRT3蛋白水平逐漸下降,而Lys 335乙酰化的SDHA和H3K4me3水平逐漸升高。
實驗數據

F:低表達Myc的DLBCL樣本、高表達Myc的DLBCL樣本和正常組織中的Myc,SIRT3,SDHA,SDHA和H3K4me3的Lys 335乙酰化的免疫組化圖像。
G:利用HistoQuest軟件對f圖中的樣本進行平均強度定量分析。
使用HistoQuest軟件對圖像進行量化進一步提供了統計結果,表明Myc表達與SIRT3蛋白水平呈負相關,與DLBCLs中Lys 335乙酰化的SDHA和H3K4me3水平呈正相關。
因此,臨床數據顯示Lys 335乙酰化的SDHA可能作為彌散性大B細胞淋巴瘤潛在的生物標記物。
https://www.nature.com/articles/s42255-020-0179-8#citeas
